富士製薬工業の品質への取り組み

富士製薬工業では、「優れた医薬品を通じて、人々の健やかな生活に貢献する」という経営理念のもと、患者さまや医療関係者の方々が安全に、かつ、安心してご使用をいただける医薬品を供給するため、品質方針や信頼性保証体制を構築しています。
本ページでは、その方針の内容や当社の取り組みについてご紹介いたします。
品質方針
品質方針の詳細についてはこちらをご覧ください。
品質方針信頼性保証体制
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律(令和元年法律第63号、以下「改正薬機法」)において、許可等業者の法令遵守体制等に関する規定の整備がなされました。
富士製薬工業では以下のような信頼性保証体制を構築し、法令遵守によるガバナンス体制の強化を図るとともに、製造販売体制の連携強化により品質・有効性・安全性の更なる確保と安定供給に努めます。
薬事に関する業務に責任を有する役員等について
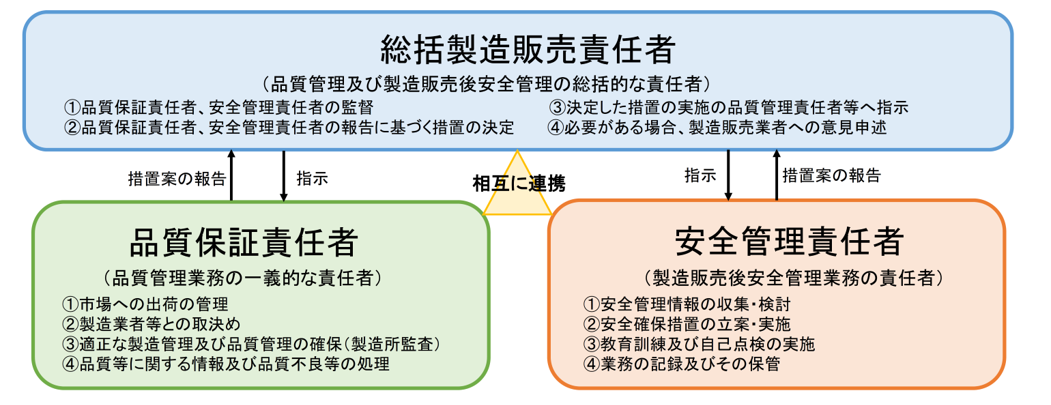
改正薬機法の趣旨を踏まえ、薬事に関する業務に責任を有する役員(責任役員)を明確にしました。また、同法の定めに基づき「医薬品総括製造販売責任者」、「品質保証責任者」、「安全管理責任者」を任命し、同三役からなる製造販売業三役体制を構築しております。
| 役職 | 氏名 | 薬事 | 品質 保証 |
安全 管理 |
製造 | 研究 開発 |
販売 | 広告 | 法令 遵守 |
|---|---|---|---|---|---|---|---|---|---|
| 代表取締役会長 | 今井 博文 | ○ | ○ | ○ | ○ | ○ | ○ | ○ | ○ |
| 代表取締役社長 兼 研究開発本部長 |
岩井 孝之 | ○ | ○ | ○ | ○ | ○ | ○ | ○ | ○ |
| 取締役副社長 富山工場長 |
上出 豊幸 | ○ | ○ | ||||||
| 取締役副社長 経営戦略本部長 |
鈴木 聡 | ○ | ○ | ○ | |||||
| 取締役 経営企画部長 |
森田 周平 | ○ | ○ | ○ |
責任役員の責任および管理のもとで、各分掌についてそれぞれ以下の者(いずれも執行役員)に業務を行わせております。
信頼性保証部長:薬事、品質保証、安全管理
営業本部長 :販売、広告
経営管理部長 :法令遵守
| 責任者 | 氏名 | 役職 |
|---|---|---|
| 医薬品総括製造販売責任者 | 桜井 和久(薬剤師) | 執行役員 信頼性保証部長 |
| 品質保証責任者 | 水口 円夫 | 信頼性保証部 品質保証グループ マネージャー |
| 安全管理責任者 | 滝川 奈央(薬剤師) | 信頼性保証部 安全管理グループ 安全管理三課 リーダー |
製造販売業三役体制
法令遵守宣言
当社の品質方針に沿い、経営理念である「優れた医薬品を通じて、人々の健やかな生活に貢献する」を実践し、法令等の遵守が最優先されることをあらためて確認するため、「法令遵守」を宣言いたします。
法令遵守宣言内部監査体制
当社の法令遵守体制を維持するため、リスクに基づく監査計画を立案し実施します。
医薬品等の製造管理、品質管理、製造販売後安全管理に関する法令遵守上の課題や問題に最も密接に関わる総括製造販売責任者、製造管理者等から責任役員への意見申述が適正に行われる体制を維持します。
製造販売体制の強化
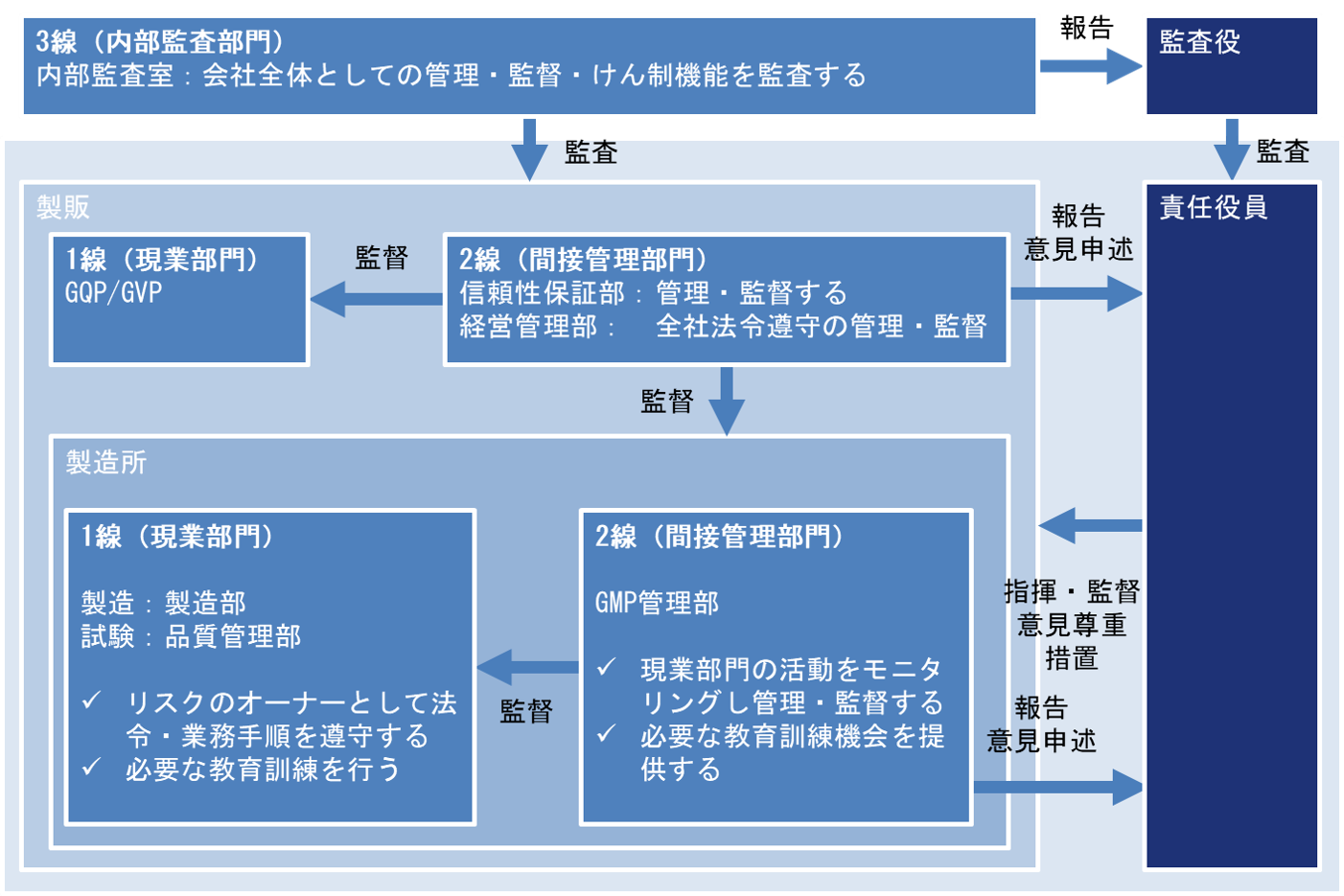
当社では、総括製造販売責任者・品質保証責任者・安全管理責任者の三役からなる製造販売業三役体制と、現業部門・間接管理部門・内部監査部門からなる三線リスク管理体制により、適正な製造所監査体制の確保を推進します。
三線リスク管理体制
製造販売承認書の点検計画及び進捗状況
当社では、日本ジェネリック製薬協会が発出した令和3年3月25日付のGE薬協会発第25号「ジェネリック医薬品の信頼性確保に関する対応について」に基づく点検を実施し、2021年12月中に完了いたしました。また、点検後の薬事対応が必要と判断した品目については、2022年6月末までに、全て対応を完了いたしました。
